MSD:s Clesrovimab(MK-1654), en långverkande monoklonal antikropp under utveckling med potential att förebygga infektion orsakad av respiratoriskt syncytievirus(RSV) hos spädbarn
30.10.2024 08:19:00 CET | MSD Sweden | Pressmeddelande
Clesrovimab reducerade både förekomst av RSV-sjukdom som krävde sjukvårdskontakt samt minskade RSV-relaterade sjukhusinläggningar hos friska för tidigt födda och fullgångna spädbarn i fas2b/3 studie.
RAHWAY, N.J., 17 oktober 2024 – Merck (NYSE: MRK), känt som MSD utanför USA och Kanada, presenterade positiva resultat från den kliniska fas 2b/3-studien (MK-1654-004) där företagets profylaktiska monoklonala antikropp under utveckling, designad för att skydda spädbarn från sjukdom orsakad av RS-virus under deras första RSV-säsong har utvärderats. Resultaten presenterades tillsammans med interimsresultat från en pågående fas 3-studie (MK-1654-007) under IDWeek 2024, 16-19 oktober i Los Angeles, Kalifornien.
I den placebokontrollerade studien MK-1654-004 där en singeldos clesrovimab gavs till friska prematura och fullgångna spädbarn (från födseln till 1 år) visades ett konsekvent resultat avseende alla effektmått, efter både 5 månader och 6 månaders uppföljning. Förekomst av biverkningar och allvarliga biverkningar var jämförbara mellan clesrovimab- och placebogruppen, och inga behandlings- eller RSV-relaterade dödsfall registrerades under studien.
Studiens primära effektmått, definierat som förekomst av RSV-relaterade luftvägsinfektioner som krävde sjukvårdskontakt (inklusive sjukhusinläggning) (MALRI) med ≥1 tecken på nedre luftvägsinfektion (LRI) eller ≥1 tecken på allvarlighetsgrad jämfört med placebo till och med dag 150 (5 månader) efter dosering, var 60,4 % (95 % KI: 44,1, 71,9, p <0,001). Behandling med clesrovimab minskade också RSV-relaterade sjukhusinläggningar (sekundärt effektmått) till och med dag 150 jämfört med placebo med 84,2 % (95 % KI: 66,6, 92,6, p <0,001).
Utöver detta visade en post hoc-analys en minskad förekomst av MALRI med ≥ 1 tecken på nedre luftvägsinfektion (LRI) och ≥ 1 tecken på allvarlighetsgrad (mer allvarlig än det primära MALRI-effektmåttet) med 88,0 % (95 % KI: 76,1, 94,0) till och med dag 150.
I tabellen nedan redovisas observerade data i sin helhet från samtliga RSV-relaterade effektmått från studien MK-1654-004 efter 5 månader och 6 månader.
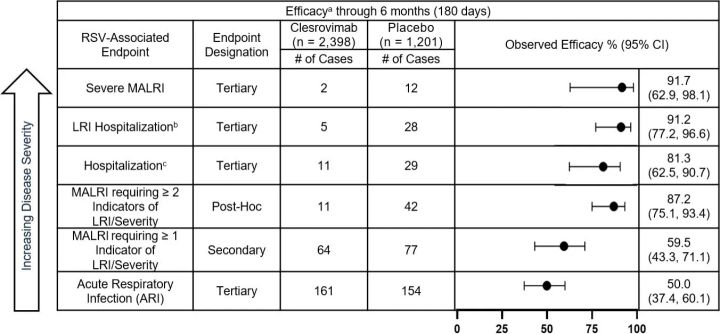
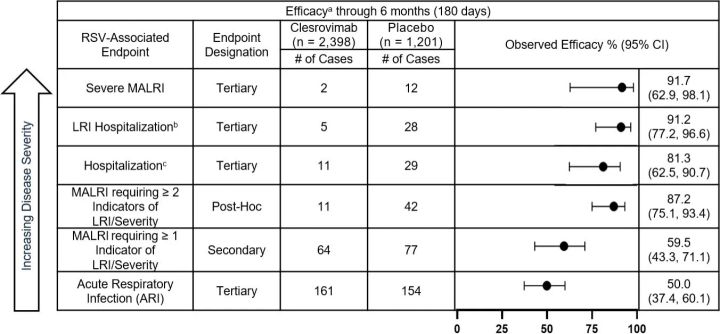
a. Komplett analys av studiepopulationen.b. LRI Sjukhusinläggning definierad som: RSV PCR positiv OCH sjukhusinläggning för luftvägssjukdom OCH hosta eller andningssvårigheter OCH minst 1 av följande: väsande andning, indragning av bröstväggen, rassel/krepitationer, hypoxemi, takypné, uttorkning på grund av andningsbesvär.c. RSV-relaterad sjukhusinläggning definierad som: RSV PCR positiv OCH sjukhusinläggning för andningsbesvär.d. Sekundärt effektmått, p <0,001 (kriterium=nedre gränsen för 95 % KI >0 %).e. Primärt effektmått, p <0,001 (kriterium=nedre gränsen för 95% KI >25%).Förkortningar: LRI=Lower Respiratory Infection; MALRI=Medically Attended Lower Respiratory Infection; ARI=Acute Respiratory Infection.
“Infektioner med RSV, som är ett vanligt säsongsvirus, kan påverka både friska spädbarn och spädbarn med riskfaktorer och är den främsta orsaken till sjukhusinläggning av spädbarn”, säger Dr. Octavio Ramilo, chef för avdelningen för infektionssjukdomar vid St. Jude’s Children’s Research Hospital och prövare i studierna MK-1654-004- och MK-1654-007. ”Resultaten som indikerar minskad förekomst av RSV-infektion och sjukhusinläggning, belyser clesrovimab’s potential att förebygga och lindra bördan av RSV-infektioner hos spädbarn och deras familjer.”
MSD presenterade också interimsdata från fas-3 studien MK-1654-007. I studien utvärderas säkerhet och effekt av clesrovimab jämfört med palivizumab hos spädbarn och barn med ökad risk för allvarlig RSV-sjukdom. Studiens primära effektmått är säkerhet och tolerabilitet av clesrovimab hos spädbarn under deras första RSV-säsong. Interimsresultaten visade att clesrovimab har en säkerhetsprofil som är jämförbar med palivizumab och hittills har inga allvarliga läkemedelsrelaterade biverkningar rapporterats.
“Resultaten som presenterades på IDWeek indikerar potential för clesrovimab att skydda både friska barn och riskgrupper mot RSV-infektion med samma dos, oavsett vikt, som kan leda till minskad belastning för hälso- och sjukvården, säger Dr. Paula Annunziato, senior vicepresident, för infektionssjukdomar och vacciner, Global Clinical Development, MSD Research Laboratories”.
Om MK-1654-004
MK-1654-004 (NCT04767373) är en fas 2b/3 dubbelblind, randomiserad, placebokontrollerad klinisk studie för att utvärdera säkerhet och effekt av clesrovimab hos friska för tidigt födda och fullgångna spädbarn från födseln till 1 års ålder under deras första RSV-säsong. I studien inkluderades 3 632 deltagare som randomiserades 2:1 och som antingen fick en fastställd dos av clesrovimab (105 mg intramuskulär injektion (IM)) eller placebo dag 1. Primära effektmått inkluderade förekomst av RSV-relaterad nedre luftvägsinfektion som krävde sjukvårdskontakt (inklusive sjukhusinläggning) (MALRI) från dag 1 till dag 150 jämfört med placebo. Definitionen av MALRI krävde ≥1 tecken på LRI eller ≥1 tecken på allvarlighetsgrad. Fördefinierade sekundära effektmått var RSV-relaterad sjukhusvård till och med dag 150 och MALRI som krävde ≥ 1 tecken på LRI eller ≥ 1 tecken på allvarlighetsgrad till dag 180. Förspecificerade tertiära effektmått inkluderade akut luftvägsinfektion, RSV-relaterad sjukhusinläggning orsakad av nedre luftvägsinfektioner och förekomsten av svår MALRI till och med dag 150. I en post hoc-analys utvärderades minskad förekomst av MALRI med ≥ 1 tecken på nedre luftvägsinfektion (LRI) och ≥ 1 tecken på allvarlighetsgrad. Samtliga effektmått utvärderades också vid dag 180. Säkerhetsanalysen omfattade förekomst av injektionsrelaterade, systemiska eller allvarliga biverkningar.
Om MK-1654-007
MK-1654-007 (NCT04938830) är en fas 3, multicenter, randomiserad, delvis blind, kontrollerad studie för att utvärdera säkerhet, effekt och farmakokinetik för clesrovimab hos spädbarn och barn med ökad risk för allvarlig RSV-sjukdom jämfört med palivizumab. Studien inkluderade barn under sin första RSV-säsong och som var rekommenderade palivizumab på grund av prematuritet (≤35 veckors graviditetsålder), kronisk lungsjukdom orsakad av prematuritet (BPD; bronkopulmonell dysplasi) eller hemodynamiskt signifikant medfödd hjärtsjukdom (ACHD; Adult Congenital Heart Disease). Deltagarna randomiserades 1:1 för att få antingen clesrovimab (105 mg IM på dag 1, placebo på dag 28) eller månatlig palivizumab under sin första RSV-säsong, och deltagare med särskilda riskfaktorer fick också clesrovimab (210 mg IM) under sin andra RSV-säsong. Vid interimsanalysen som presenterades på IDWeek ingick 901 deltagare. De primära effektmåtten var säkerhet och tolerabilitet för clesrovimab jämfört med palivizumab under den första RSV-säsongen. Sekundära effektmått inkluderade incidens av RSV-relaterade nedre luftvägsinfektioner som krävde sjukvårdskontakt (MALRI) med ≥ 1 tecken på LRI eller ≥ 1 tecken på allvarlighetsgrad och RSV-relaterad sjukhusvård till och med dag 150.
Om clesrovimab (MK-1654)
Clesrovimab (MK-1654) är en långverkande monoklonal antikropp (mAb) utvecklad för att via passiv immunisering förebygga infektion med RS-virus. Clesrovimab har administrerats som en engångsdos, oavsett födelsevikt, och studeras på friska prematura och fullgångna spädbarn samt spädbarn med riskfaktorer för att ge ett skydd under deras första RSV-säsong mot mild, måttlig och svår RSV.
SE-NON-01462 10/2024
Kontakter
PresskontaktCommunications Manager
Tel:08-20 75 00mediasweden@msd.comOm MSD
På MSD är vi enade i vårt syfte: vi använder kraften i ledande vetenskap för att rädda och förbättra liv runt om i världen. I mer än 130 år har vi gett hopp till mänskligheten genom att utveckla viktiga läkemedel och vacciner. Vi strävar efter att vara det främsta forskningsfokuserade biofarmaceutiska företaget i världen – och idag är vi i framkant för forskningen för att leverera innovativa lösningar inom hälsa som bidrar till att förebygga och behandla sjukdomar hos människor och djur. Vi främjar en mångsidig och inkluderande global arbetsplats och arbetar ansvarsfullt varje dag för att möjliggöra en säker, hållbar och hälsosam framtid för alla människor och samhällen. För mer information, se www.msd.se och följ oss på, YouTube och LinkedIn.
Följ MSD Sweden
Abonnera på våra pressmeddelanden. Endast mejladress behövs och den används bara här. Du kan avanmäla dig när som helst.
Senaste pressmeddelandena från MSD Sweden
EU-godkännandet för WINREVAIR (sotatercept) omfattar nu vuxna med PAH i WHO-funktionsklass II–IV2.2.2026 09:48:28 CET | Pressmeddelande
Läkemedelsbolaget MSD Sverige meddelar att Europeiska kommissionen har godkänt en uppdaterad indikation för Winrevair (sotatercept) inom EU*. Indikationen omfattar nu behandling av pulmonell arteriell hypertension (PAH) hos vuxna patienter i WHO-funktionsklass (FC) II, III och IV, i kombination med andra PAH-behandlingar.
Europeiska kommissionen godkänner CAPVAXIVE® (ett 21-valent konjugerat pneumokockvaccin) för prevention av pneumokocksjukdomar hos vuxna28.3.2025 12:24:00 CET | Pressmeddelande
Beslutet från Europeiska kommissionen1 markerar det fjärde godkännandet globalt för CAPVAXIVE pneumokockvaccin för vuxna
Birgitta Wikman Erlandson blir ny vd för MSD Sverige25.11.2024 00:00:00 CET | Pressmeddelande
Stockholm, 25 november 2024 – MSD Sverige meddelar i dag att Birgitta Wikman Erlandson tillträder som ny vd.
EU-kommissionen godkänner KEYTRUDA® (pembrolizumab) för två nya indikationer vid gynekologisk cancer.8.11.2024 12:26:00 CET | Pressmeddelande
I Sverige diagnostiseras drygt 3 000 kvinnor med gynekologisk cancersjukdom varje år, varav 1400 med endometriecancer. Endometriecancer som också kallas livmoderkroppscancer eller corpuscancer, är den vanligaste gynekologiska tumörformen i Sverige. Cervixcancer (livmoderhalscancer) orsakas i stor utsträckning av humant papillomvirus och varje år i Sverige diagnostiseras 500 kvinnor med cervixcancer varav 150 mister livet1.
EU-kommissionen godkänner MSD:s KEYTRUDA® (pembrolizumab) i kombination med PADCEV® (enfortumab vedotin) som första linjens behandling för vuxna patienter med inoperabel eller metastaserad urinblåsecancer18.9.2024 15:12:00 CEST | Pressmeddelande
Godkännande av KEYTRUDA i kombination med enfortumab vedotin innebär en potentiell ny standardbehandling i första linjen för dessa patienter.
I vårt pressrum kan du läsa de senaste pressmeddelandena, få tillgång till pressmaterial och hitta kontaktinformation.
Besök vårt pressrum